LABORATORIO YENKA
LABORATORIO DE QUÍMICA - YENKA
INTRODUCCIÓN
Mediante este blog daré a conocer todos los aspectos relacionados con la definición de ph, neutralización, sustitución ,fenolftaleína,el universal y el tornasol consultando sobre su aplicación y procedimiento De esta manera podremos desarrollar bien la temática y obtener buenos resultados en el momento de realizar ejercicios relacionados con dicho tema.
Debemos de tener en cuenta que reconocer todos los aspectos anteriormente descritos es de fundamental importancia ya que esto lo estaremos empleando durante el cuarto periodo académico
Espero mediante este blog entender mejor todo lo relacionado con los temas ya anteriormente mencionados para aclarar algunas dudas, para conocer el procedimiento para su solución y poder practicar para comprender la temática.
TABLA DE CONTENIDO
- Que es ph
- Que es neutralizacion
- Que es sustitucion
- Cual es la fenoctaleina
- Que es el universal
- Cual es el tornasol
OBJETIVO GENERAL
1. Comprender todo lo relacionado con el ph, neutralizacion, subtitulacion, fenoctaleina,el universal y el tornasol empleando las formulas y pasos indicadas para la correcta solucion.
OBJETIVO ESPECIFICO
1. Reconocer el uso y la aplicacion del ph, neutralizacion, subtitulacion, fenoctaleina,el universal y el tornasol.
2. Poder conocer los procesos como y cuando se pueden realizar un ejercicio ph, teniendo en cuenta la escala determinada en donde se indica la acidez y basicidad.
3. Estudiar claramente su estado el proceso, del ph, de la fenoctaleina y el tornasol
4. reconocer todo lo relacionado con la neutralizacion y subtitulacion
PROCEDIMIENTO
- Buscar en el computador yenka
- Dar clik en quimica organica
- iniciar buscando el ph y sus indicadores
- Buscar que es ph de tornasol
- Resolver la actividad, tomar sc y subirlo al blog
- Que es el universal
- Buscar la fenoftaleina
- Resolver la actividad, tomar sc y subirlo al blog
- solucionar los ejercicios
- en el buscador consultar todo lo relacionado con ph, fenoftaleina, tornasol, el universal, neutralizacion y subtitulacion
MARCO TEORICO
DEFINICIÓN DE PH
El pH es una medida de la acidez y de la alcalinidad de una sustancia. Tiene un rango que va desde 0 a 14. Una sustancia con pH entre 0 y 7 es una sustancia ácida y una sustancia entre 7 y 14 es una sustancia alcalina. El agua potable tiene un pH entre 6 y 9. Fuera de esos valores sería perjudicial para la salud, puesto que sería corrosiva. Cuando 2 sustancias tienen diferente pH (siendo una ácida y la otra alcalina) crean una reacción. Uno de los productos conocidos más ácidos sería el ácido clorhídrico (con pH menor de 1) y uno de los más alcalinos que conocemos sería la lejía (con pH cercano a 14).
A nivel de definición o concepto, de forma técnica, el pH El pH indica la concentración de iones del átomo de hidrógeno (H+) presentes en una disolución. La sigla de pH significa potencial de hidrógeno.
El pH es el logaritmo negativo de base 10 de la actividad de los iones hidrógeno:
El término pH se ha consolidado y es utilizado de forma universal ya que describe de forma sencilla lo que de otra forma habría que hacer con cifras muy complejas.
ESCALA DE PH
La escala del pH es una escala numérica que va de 0 a 14. El conocimiento de la escala es fundamental para poder trabajar con el pH. Aquí puedes ver la escala del pH. Verás que es una escala que va del 1 al 14, donde entre el 1 y el 7 corresponden al pH ácido y entre 7 y 14 al pH alcalino. Los productos ácidos son aquellos productos que van a tener un pH menor que 7, ya sea ácido cítrico, bórico o cualquier tipo de ácido. Leer escala del ph
MEDICIÓN DE PH
Existen diversas formas de medición del pH. Desde aparatos sencillos y caseros, tiras de medición, y también indicadores de medida. Según el grado de precisión que quieras obtener (y presupuesto y tiempo que vas a dedicar a la medición del pH), tienes diversas formas de medida del pH. En este apartado puedes encontrar toda la información relativa a los medidores de pH.
- Medidores de pH. Hoy en día encontrarás múltiples tablas y valores en Internet con muchísimos valores típicos del pH. No obstante el conocer cómo medir el pH, y poderlo aplicar es una técnica que nunca te va a faltar. Aquí te presentamos algunos medidores de pH sencillos, como los ph-metros o los indicadores de pH, rojo fenol, fenolftaleína, azul de metileno.
PORQUÉ ES IMPORTANTE EL PH
Conocer bien el pH y saberlo medir nos puede ayudar a tomar miles de decisiones importantes, no sólo en la nutrición, sino en el cuidado personal, en la limpieza,…, además es un factor primordial del agua, tanto de la que bebemos, de la piscina, del mar, del océano.
- El océano es el gran regulador de clima del planeta. Consigue absorber el CO2 manteniendo el pH en equilibrio. Un desequilibrio del pH del océano significaría la desaparición de la gran parte de las especies que conocemos.
- Nuestro cuerpo es el otro gran equilibrador del pH. La gran parte de los procesos se dan a determinados valores de pH. Los procesos digestivos, la sangre, la orina, tienen sus valores óptimos de pH.
- Cuando nos sentimos pesados, tomamos algo ácido como un zumo de limón para la digestión, y cuando tenemos acidez nos tomamos un elemento básico. El pH de los alimentos es fundamental para conocer cómo afecta nuestra alimentación.
- Si alguna vez has usado un desatascador, su funcionamiento “casi mágico” se debe a su elevado valor de pH, capaz de reaccionar y disolver sustancias de valores más bajos.
- Los experimentos químicos más vistosos para niños, se dan 2 tipos de reacciones: ácido-base (donde interviene el pH) y reacciones oxidación-reducción (interviene el potencial de oxidación). Son las 2 reacciones más importantes en la vida humana y en la naturaleza.
Como puedes ver, el pH lo tenemos por todos lados. Conociendo el pH podremos conocernos mejor a nosotros mismos, y tomar decisiones más inteligentes en cuanto a lo que comemos, nuestra higiene y conocer mejor nuestra naturaleza, comenzando por el mar, el océano.
NEUTRALIZACION
La Neutralización ácido base.Proceso por el que una disolución ácida o básica pasa a ser neutra. Las disoluciones ácidas se neutralizan con disoluciones básicas y al revés. Aunque no siempre se obtiene una solución neutra al hacer reaccionar un ácido con una base, sólo se obtienen soluciones neutras cuando el ácido y la base tienen la misma fuerza.
Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
La más común es la reacción de un ácido fuerte contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar casos de neutralización.
HCl + NaOH —-> NaCl + H2O
En este caso vemos al ácido clorhídrico contra el hidróxido de sodio. Genera cloruro de sodio y agua. En este caso basta una molécula de ácido con una molécula de la base para generar la sal. Pero no siempre es asi.
2 NaOH + H2SO4 —-> Na2SO4 + 2 H20
Aquí se necesitan 2 moléculas de la base contra 1 del ácido para formar el sulfato de sodio.
Este principio se usa para averiguar la molaridad de un ácido o de una base gracias a un procedimiento llamado valoración acido base o titulación acido base. Por ejemplo, si se quiere averiguar la molaridad de un ácido se coloca a la solución de este en un erlenmeyer y se la enfrenta con otra solución de un hidróxido de concentración excatmente conocida. Esta solución de la base se la coloca en una bureta quedando por encima del erlenmeyer que tiene la solución problema del ácido. Colocamos una gota de un indicador en el erlenmeyer para que nos indique el momento exacto en el cual se ha producido la neutralización, o sea, cuando no haya exceso de base ni ácido, por ejemplo la fenolftaleína. Dejamos caer gota a gota desde la bureta al Erlenmeyer haciendo movimiendos suaves y circulares para una correcta titulación. Apenas vemos un cambio de coloración al rosa cesamos al agregado de la solución de hidróxido de sodio. Medimos el volumen agregado de la solución de NaOH y hacemos los cálculos correspondientes.
CARACTERISTICAS
- La neutralización es la combinación de cationes hidrogeno y de aniones hidróxido para formar moléculas de agua.
- Se le conoce también como la reacción química formada de un ácido con una base.
- Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
- En una reacción química; cuerpos o sustancias experimentan transformaciones que alteran su composición dando origen a: sustancias nuevas.
- Cambios en sus propiedades.
- Las que experimentan cambios se denominan reactivos y los que se forman productos.
- De la reacción química formado por un ácido base se obtienen compuestos llamados sales.
SUSTITUCION
Una Reacción de sustitución es aquella donde un átomo o grupo en un compuesto químico es sustituido por otro átomo o grupo. Son procesos químicos donde las sustancias intervinientes, sufren cambios en su estructura, para dar origen a otras sustancias. El cambio es más fácil entre sustancias líquidas o gaseosas, o en disolución, debido a que se hallan más separadas y permiten un contacto más íntimo entre los cuerpos reaccionantes.
Tipos de sustitución
Las reacciones de sustitución encuentran su clasificación específica desde el punto de vista orgánico o inorgánico.
Reacciones de simple sustitución
Cuando una sustancia simple reacciona con otra compuesta, reemplazando a uno de sus componentes.
Cu + AgNO3= Cu (NO3)2 + Ag
Reacciones de doble sustitución:
Se denominan de doble desplazamiento o metátesis y ocurren cuando hay intercambio de elementos entre dos compuestos diferentes y de esta manera originan nuevas sustancias. * Se presentan cuando las sustancias reaccionantes están en estado iónico por encontrarse en solución, combinándose entre sí sus iones con mucha facilidad, para formar sustancias que permanecen estables en el medio reaccionante:
BaO2 + H2SO4 = BaSO4 + H2O2
Química orgánica
En química orgánica las sustituciones nucleófilas o electrófilas son muy importantes. Las reacciones de sustitución se clasifican en diferentes tipos según si el reactivo que lleva a cabo la sustitución es un nucléofilo, un electrófilo o un radical libre o si el sustrato es alifático o aromático. El entendimiento detallado de las diferentes reacciones de sustitución ayuda a predecir el producto resultante. Esto además permite optimizar una reacción respecto a variables como la temperatura o la elección del disolvente.
Etapas de la sustitución
Sustrato. Recibe este nombre la molécula en la cual tiene lugar la sustitución.
Reactivo o grupo entrante. Es el átomo o grupo de átomos que ataca al sustrato.
Grupo saliente. Es el átomo o grupo de átomos que es expulsado del sustrato.
Producto. Es el resultado de la sustitución del grupo saliente por el nucleófilo.
Cuando el reactivo es un nucleófilo se produce una sustitución nucleofílica
El ataque se produce en el carbono indicado por la flecha azul puesto que el Br es más electronegativo que el C,por lo que el Br "tira" de los electrones del enlace (adquiriendo una carga parcial negativa) y llevándose dichos electrones al producirse el ataque del nucleófilo. El nucleófilo puede tener carga negativa o neutra.El sustrato puede ser neutro o tener carga positiva.Existen,pues,cuatro posibilidades:
1.Nu:- + R-L ----> Nu-R + :L-
2.Nu: + R-L ----> [Nu-R]+ + :L-
3.Nu:- + R-L + ----> Nu-R + :L
4.Nu: + R-L+ ----> [Nu-R]+ + :L
Si el nucleófilo es negativo, el producto es neutro.
Si el nucleófilo es neutro, el producto es positivo.
Estas reacciones pueden tener lugar según dos mecanismos diferentes:
Sustitución nucleofílica monomolecular (SN1).En este caso la reacción procede por etapas,disociándose primero los compuestos en sus iones y reaccionando después estos iones entre sí.Se produce por medio de carbocationes.
Sustitución nucleofílica bimolecular (SN2).En este caso la reacción transcurre en una sola etapa,produciéndose simultáneamente el ataque del reactivo y la expulsión del grupo saliente.En este caso,si el ataque tiene lugar sobre un carbono quiral se produce una inversión en la configuración,aunque puede no pasar de R a S o viceversa, puesto que el sustituyente puede alterar el orden de prioridades.
FENOLFTALEINA
Es un colorante orgánico, el cual es a su vez un ácido débil diprótico, usado en muchas determinaciones volumétricas como indicador ácido-base. Es decir, si es un ácido diprótico, en solución puede perder dos iones H+, y para ser un indicador debe tener la propiedad de ser colorido en el rango de pH que se está valorando.
En medio básico (pH>8) la fenolftaleína es de color rosado, el cual puede intensificarse hasta un rojo violáceo (tal como ilustra la siguiente imagen). Para ser utilizado como indicador ácido-base no debe reaccionar con mayor rapidez con los OH– del medio que los analitos a determinar.
Además, como es un ácido muy débil la presencia de los grupos –COOH queda descartada y, por tanto, la fuente de los protones ácidos son dos grupos OH enlazados a dos anillos aromáticos.
Fórmula
La fenolftaleína es un compuesto orgánico cuya fórmula química condensada es C20H14O4. Aunque quizás no sea suficiente para descubrir qué grupos orgánicos posee, a partir de la fórmula se pueden calcular las insaturaciones, para así empezar a dilucidar su esqueleto.
Estructura química
La estructura de la fenolftaleína es dinámica, lo que significa que sufre cambios dependiendo del pH de su entorno. En la imagen superior está ilustrada la estructura de la fenolftaleína en el rango de 0 <pH < 8. Posee cuatro anillos, de los cuales tres son aromáticos y hexagonales, y uno es pentagonal.
Es el anillo pentagonal el que sufre las mayores modificaciones. Por ejemplo, en medio básico, al desprotonarse uno de los grupos OH de los anillos fenólicos, su carga negativa (-O–) es atraída por el anillo aromático, “abriendo” el anillo pentagonal en el nuevo arreglo de sus enlaces.
Aquí, la nueva carga negativa está localizada en el grupo –COO–, el cual “se desprendió” del anillo pentagonal.
Luego, tras aumentar la basicidad del medio, se desprotona el segundo grupo OH de los anillos fenólicos y la carga resultante se deslocaliza por toda la estructura molecular.
La imagen inferior resume el resultado de las dos desprotonación en medio básico. Es esta estructura la responsable de la coloración rosada tan familiar de la fenolftaleína.
Los electrones que “viajan” por el sistema π conjugado (representado con los dobles enlaces resonantes) absorben en el espectro visible, específicamente a la longitud de onda del color amarillo, reflejando el color rosado que llega a los ojos del expectador.
La fenolftaleína tiene en total cuatro estructuras. Las dos anteriores son las más importantes en términos prácticos y se representan abreviadamente como: H2In y In2-.
Función de indicador
La fenolftaleína es usada en análisis químicos como un indicador visual en la determinación del punto de equivalencia en las reacciones de neutralización o titulaciones ácido-base. El reactivo para estas valoraciones ácido-base se prepara al 1% disuelta en alcohol de 90 %.
La fenolftaleína presenta 4 estados:
– En un medio fuertemente ácido presenta una coloración naranja (H3In+).
– Al aumentar el pH y hacerse ligeramente básico, la solución se torna incolora (H2In).
– En la forma aniónica al perder el segundo protón, se genera un cambio de color en la solución de incoloro a rojo violáceo (In2-), esto como consecuencia del aumento de pH entre 8,0 a 9,6.
– En un medio fuertemente básico (pH>13), la coloración es incolora (In(OH)3-).
Este comportamiento ha permitido el uso de la fenolftaleína como un indicio de la carbonación del concreto, el cual hace variar el pH a un valor entre 8,5 a 9.
Asimismo, el cambio de coloración es muy brusco; es decir, que el anión In2- rosado se produce a gran velocidad. En consecuencia, esto le permite ser un candidato como indicador en muchas determinaciones volumétricas; por ejemplo, la de un ácido débil (ácido acético) o fuerte (ácido clorhídrico).
USOS
Usos en medicina
La fenolftaleína se usó como agente laxativo. Sin embargo, existe una literatura científica indicativa de que algunos laxantes que contienen como principio activo la fenolftaleína —que actúa inhibiendo la absorción de agua y electrolitos en el intestino grueso promoviendo las evacuaciones— podrían tener efectos negativos.
El uso prolongado de estos medicamentos que contienen fenolftaleína se encuentra asociado a la producción de varios trastornos en el funcionamiento intestinal, pancreatitis e incluso cáncer, producidos principalmente en mujeres y en los modelos animales utilizados para el estudio farmacológico de este compuesto químico.
La fenolftaleína modificada químicamente, para luego transformarla en su estado reducido, es usada como reactivo en las pruebas forenses que permiten determinar la presencia de la hemoglobina en una muestra (prueba de Kastle-Meyer), que no es concluyente por la presencia de falsos positivos.
Preparación
Se forma de la condensación del anhídrido ftálico con el fenol, en presencia de ácido sulfúrico concentrado, y de una mezcla cloruros de aluminio y de zinc como catalizadores de la reacción:
La sustitución electrofílica aromática es el mecanismo que rige esta reacción. ¿En qué consiste? El anillo fenólico (la molécula de la izquierda) está cargado negativamente gracias al átomo de oxígeno rico en electrones, el cual es capaz de hacer que cualquier par libre de ellos recorra “el circuito electrónico” del anillo.
Por otro lado, el carbono del grupo C=O del anhídrido ftálico está muy desprotegido, debido a que el anillo ftálico y los átomos de oxígeno le sustraen densidad electrónica, llevando así una carga parcial positiva. El anillo fenólico, rico en electrones, ataca a este carbono pobre en electrones, incorporándose el primer anillo a la estructura.
Este ataque ocurre preferencialmente en el extremo opuesto del carbono enlazado al grupo OH; esta es la posición –para.
Lo mismo ocurre con el segundo anillo: ataca al mismo carbono y de este se libera una molécula de agua generada gracias al medio ácido.
De este modo, la fenolftaleína no es más que una molécula de anhídrido ftálico que ha incorporado dos anillos fenólicos en uno de sus grupos carbonillos (C=O).
Propiedades
Su aspecto físico es el de un sólido blanco con cristales triclínicos, a menudo aglomerados o en forma de agujas rómbicas. Es inodoro, más denso que el agua líquida (1,277 g/mL a 32 ºC), y muy poco volátil (presión de vapor estimada: 6,7 x 10-13 mmHg).
Es muy poco soluble en agua (400 mg/l), pero muy soluble en alcoholes y éter. Por esta razón se recomienda diluirlo en etanol antes de ser empleado.
Es insoluble en solventes aromáticos como benceno y tolueno, o en hidrocarburos alifáticos como n-hexano.
Funde a 262,5 ºC y el líquido tiene un punto de ebullición de 557,8±50,0 ºC a la presión atmosférica. Estos valores son indicativos de las fuertes interacciones intermoleculares. Esto es debido a los puentes de hidrógeno, así como a las interacciones frontales entre los anillos.
Su pKa es de 9,7 a 25 ºC. Esto se traduce en una tendencia muy baja para disociarse en medio acuoso:
H2In(ac) + 2H2O(l) <=> In2-(ac) + 2H3O+
Este es un equilibrio en medio acuoso. Sin embargo, el aumento de los iones OH– en la solución disminuye la cantidad presente de H3O+.
Consecuentemente, el equilibrio se desplaza a la derecha, para producir más H3O+. De este modo se recompensa su pérdida inicial.
A medida que se agrega más base, el equilibrio sigue desplazándose hacia la derecha, y así sucesivamente hasta no quedar nada de la especie H2In. En este punto, la especie In2- colorea de rosado la solución.
Por último, la fenolftaleína se descompone al calentarse.

TORNASOL
En Química, para averiguar si un líquido es ácido o alcalino, se hace la prueba con una tira de papel de filtro impregnada de tornasol: los ácidos vuelven rojo el papel azul, y los álcalis o bases vuelven azul el papel rojo.
El tornasol es una substancia colorante purpúrea que se extrae de distintas especies de liqúenes. Éstos se trituran en agua hasta convertirlos en pulpa, la cual se mezcla con carbonato de calcio para hacer una pasta, y luego, se comprime ésta en cubitos. Los cubos sirven para preparar el papel y tintura de tornasol. El papel neutro es morado. El papel azul se prepara añadiendo al morado unas cuantas gotas de álcali, y el rojo, añadiéndole unas gotas de ácido.

USOS
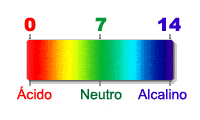
El Papel tornasol o Papel pH es utilizado para medir la concentración de Iones Hidrógenos contenido en una sustancia o disolución. Mediante la escala de pH, la cual es clasificada en distintos colores y tipos. El papel tornasol se sumerge en soluciones y luego se retira para su comparación con la escala de pH.
MARCO DE DESARROLLO
NEUTRALIZACION
TITULACION
CONCLUSIONES
- El tornasol es un tipo de papel con el que podemos medir el ph
- la neutralizacion es un Proceso por el que una disolución ácida o básica pasa a ser neutra.
- el ph nos ayuda a medir la al acalinidad o la basicidad
- Del 1 al 6 es acido, el 7 neutro y del 8 al 14 alcalino
WEBGRAFIA
- https://www.experimentoscientificos.es/ph/
- https://www.ecured.cu/PH_(acidez)
- https://www.ecovidasolar.es/blog/ph-en-el-cuerpo-y-ph-en-el-agua/
- http://www.ehu.eus/biomoleculas/ph/neutra.htm
- https://www.tplaboratorioquimico.com/quimica-general/acidos-y-bases/neutralizacion.html
- http://recursostic.educacion.es/newton/web/materiales_didacticos/acidosbases/reacacidobase.html
- http://oustilowsti.blogspot.com/2009/08/fenoftaleina.html
- https://www.tplaboratorioquimico.com/laboratorio-quimico/materiales-e-instrumentos-de-un-laboratorio-quimico/papel-tornasol-o-papel-ph.html

Eran informes por separado 4.0
ResponderEliminar