REACCIONES QUIMICAS
REACCIONES Y ECUACIONES QUIMICAS
INTRODUCCION
Mediante este blog dare a conocer todos los aspectos relacionados con una ecuacion quimica y las reacciones, como lo es su clasificacion y la forma adecuada de formarlas. De esta manera podremos desarrollar bien la tematica y obtener buenos resultados en el momento de realizar ejercicios relacionados con dicho tema.
Debemos de tener en cuenta que reconocer todos los aspectos anteriormente descritos es de fundamental importancia ya que esto lo estaremos empleando durante el segundo periodo academico.
Espero mediante este blog entender mejor todo lo relacionado con las reacciones y ecuaciones quimicas, poder aclarar algunas dudas, reconocer su procedimiento, correguir en cierto punto los errores y sobre todo aprender y continuar avanzando en quimica.

TABLA DE CONTENIDO
1. ¿Que es una Reaccion Quimica?
2. ¿Que es una Ecuacion Quimica?
3. ¿Como se escribe una Ecuacion Quimica?
4. Clases de Reacciones
OBJETIVO GENERAL
1. Dar a conocer todo lo relacionado con las Reacciones y Ecuaciones quimicas para un buen desarrollo de las actividades en donde sean utilizadas.
OBJETIVOS ESPECÍFICOS
1. Conocer los conceptos básicos que se debe de tener en cuenta para una Reaccion y Ecuacion quimica
2. Reconocimiento de las Reacciones y Ecuaciones quimicas
3. Dar a conocer cada uno de los aspectos relacionados con las Reacciones y Ecuaciones (Clasificacion, estructura...)
4. Conocer que pasos se deben de tener en cuenta para la realizacion de una Reaccion
PROCEDIMIENTO
1. Entrar al ordenador y buscar la definicion de Reacciones quimicas
2. Leer el concepto y complementar con otras fuentes de informacion
3. Escribir la informacion en el blog
4. Continuar con la consulta sobre Ecuaciones Quimicas
5. Escribir el proceso para realizar o escribir una ecuacion quimica
6. Consultar sobre las clases de reacciones, complementar la informacion y continuar desarrollando el blog
MARCO TEORICO
REACCIONES QUIMICAS
Es un proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. La masa de las sustancias participantes es la misma antes y después de la reacción, es decir, se conserva. Esto sucede porque sólo se lleva a cabo un reordenamiento entre los átomos de los reactivos, que se rompen y forman nuevos enlaces.
Las reacciones químicas se representan mediante ecuaciones químicas, en las cuales se emplean varios símbolos para indicar los procesos y sustancias involucradas.
La física reconoce dos grandes modelos de reacciones químicas, las reacciones ácido-base, que no presentan modificaciones en los estados de oxidación y las reacciones redox, que por el contrario sí presentan modificaciones en los estados de oxidación.

EJEMPLO: El bicarbonato de sodio es una base débil que al reaccionar con ácido como el vinagre o el agua (que es ligeramente ácida) libera dióxido de carbono.
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2
Este compuesto es el ingrediente activo de muchos antiácidos
CARACTERISTICAS DE UNA REACCION QUIMICA
1. La o las sustancias nuevas que se forman suelen presentar un aspecto totalmente diferente del que tenían las sustancias de partida.
2.Durante la reacción se desprende o se absorbe energía:
Reacción exotérmica: se desprende energía en el curso de la reacción.
Reacción endotérmica: se absorbe energía durante el curso de la reacción.
3.Se cumple la ley de conservación de la masa: la suma de las masas de los reactivos es igual a la suma de las masas de los productos. Esto es así porque durante la reacción los átomos ni aparecen ni desaparecen, sólo se reordenan en una disposición distinta.
FACTORES QUE AFECTAN EN UNA REACCION QUIMICA
Naturaleza de los reactivos: según los reactivos que intervengan, las reacciones tienen distinta velocidad, pero no se ha podido establecer aún unas reglas generales.
Concentración de los reactivos: La velocidad de reacción aumenta con la concentración de los reactivos. Para aumentar la concentración de un reactivo:
- Si es un gas, se consigue elevando su presión.
- Si se encuentra en disolución, se consigue cambiando la relación entre el soluto y el disolvente.

Superficie de contacto de los reactivos: Cuanto más divididos están los reactivos, más rápida es la reacción. Esto es así porque se aumenta la superficie expuesta a la misma.

Temperatura: la velocidad de una reacción química aumenta conforme se eleva la temperatura.

Presencia de catalizadores: sustancia, distinta a los reactivos o los productos, que modifican la velocidad de una reacción. Al final de la misma, el catalizador se recupera por completo e inalterado.
Los catalizadores aumentan la velocidad de la reacción, pero no la cantidad de producto que se forma.

CLASES DE REACCIONES QUIMICAS
- Reacción Ácido-Base: también llamada reacción de neutralización, es aquella que ocurre entre un ácido y una base para dar lugar a una sal y agua:
- HCl + NaOH → NaCl + H2O
- H2SO4 + 2 NaOH → Na2SO4
+ H2O

- Reacción de Adición: uno o varios átomos se unen a una molécula que posee un doble o triple enlace destruyéndolo. Se dan principalmente en química orgánica:
- CH2=CH2 + HBr → CH3-CH2Br
- CH2=CH2 + H-H → CH3-CH3
- Reacción en Cadena: en ella, los productos de la reacción pueden producir reacciones adicionales repitiéndose el ciclo indefinidamente.
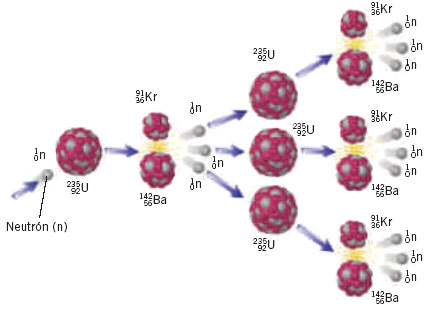
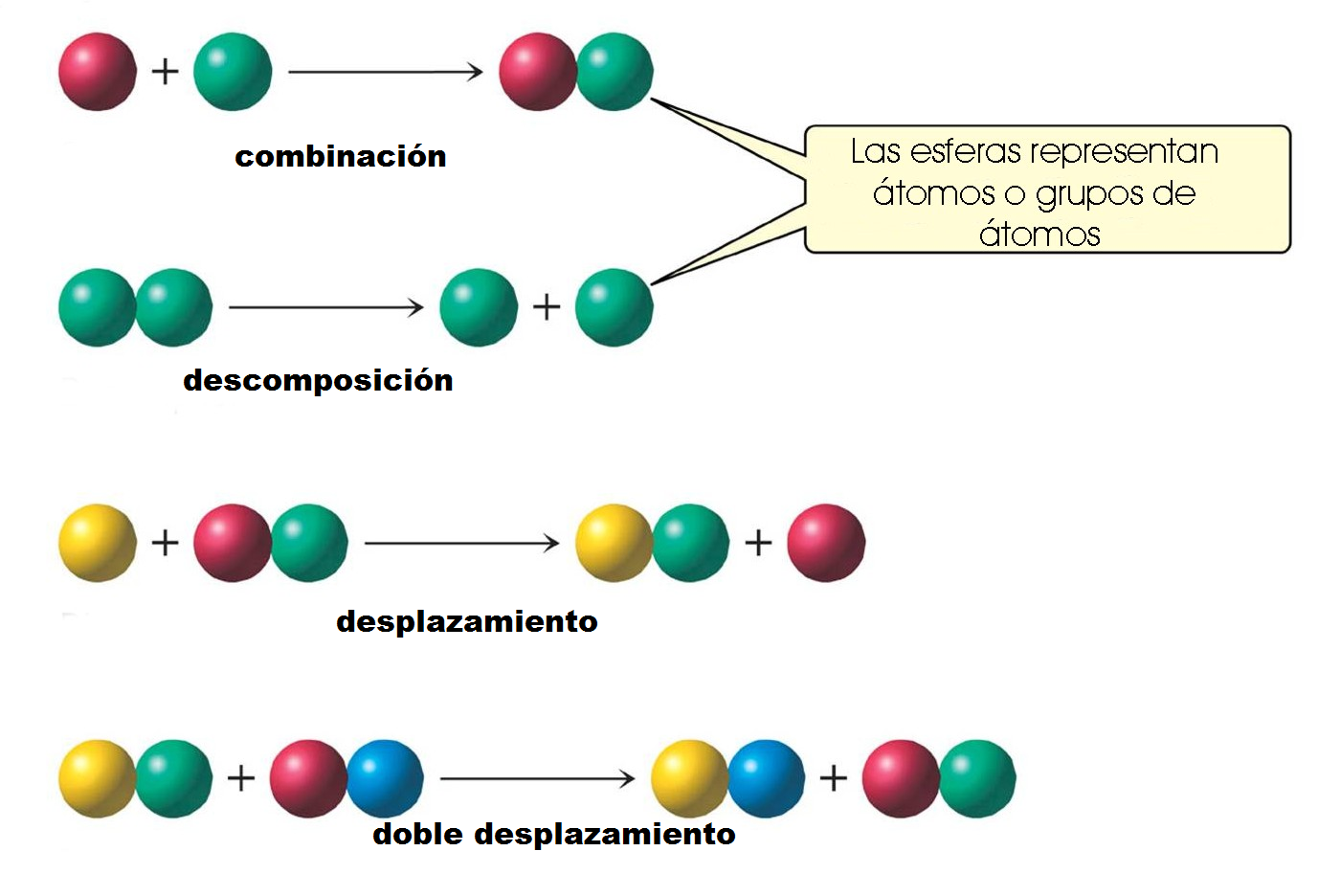
- Reacción de Combinación: también llamada reacción de síntesis, es aquella en la que se unen dos o más sustancias para formar otra cuyo resultado es la reagrupación de los átomos iniciales (A + B → AB), Los reactivos pueden ser elementos o compuestos, pero el producto siempre es un compuesto.
- N2 + 3 H2 → 2 NH3
- Cl2 +H2 → 2 HCl
- 2 Na + Cl2 → 2 NaCl
- SO3 + H2O → H2SO4
- Reacción de Condensación: en química orgánica es aquella reacción en la que dos moléculas se unen para dar un único producto más agua.
- CH3COOH + CH3OH →
CH3COOCH3 + H2O

- Reacción de Descomposición: es la reacción contraria a la de combinación. Ocurre cuando a partir de un compuesto se forman dos o más sustancias (AB → A + B), El reactivo siempre debe ser un compuesto, y los productos pueden ser elemento o compuestos más sencillos.
- Las reacciones de análisis pueden recibir nombres particulares, de acuerdo con el agente causante de la reacción.
- Pirólisis = descomposión por el calor
- Fotolísis = descomposición por la luz
- Electrólisis = descomposición por la electricidad
- Hidrólisis = descomposición por el agua
- 2 H2O → 2 H2 + O2
- H2CO3 →
CO2 + H2O - CaCO3 → CaO + CO2

- Reacción de Desplazamiento: un elemento de un compuesto es sustituido por otro que está presente en la reacción (A + BC → B + AC), E aprece como elemento libre, por esto los reactivos y los productos son un elemento y un compuesto.
- 2 NaI + Br2 → 2 NaBr + I2
- Reaccion de desplazamiento doble: Reacción de doble desplazamiento.- La forma general de este tipo de reacciones es:AB + CD AC + BD En este tipo de reacción, participan dos compuestos en los cuales el ion positivo (catión) de un compuesto, se intercambia con el catión del otro
- Reacción de Dismutación: también llamada reacción de desproporción, es aquella donde un elemento es simultáneamente oxidado y reducido:
- 2 H2O2 → 2 H2O + O2

- Reacción de Doble Sustitución: se produce cuando dos compuestos intercambian elementos produciéndose otros nuevos (AB + CD → CB + AD):
- HCl + NaOH → NaCl + H2O (neutralización ácido-base)
- Reacción Elemental: es aquella reacción que se produce en un único paso sin etapas intermedias o estados de transición.

- Reacción de Eliminación: es el proceso contrario a la reacción de adición
- CH3CH2CHBrCH3 + NaOH → CH3–CH=CH–CH3
- CH3-CH2-CHOH-CH3 + H2SO4 → CH3–CH=CH–CH3
- R-CH2-CH2-X → R-CH=CH2 + H-X

- Reacción Exorgónica: reacción química donde la variación de la energía libre de Gibbs

- Reacción Iónica: interacción eléctrica de especies iónicas solvatadas o dispersos en el disolvente:
- Ag+ + Cl- → AgCl
- Reacción Limitante: es el paso de una reacción que se produce más lentamente y que por lo tanto limita la velocidad de la reacción global.

- Reacción Orgánica: son las reacciones de los compuestos orgánicos

- Reacción Redox: reacción en la que existe una transferencia electrónica entre los reactivos. También se denomina reacción de oxidación-reducción
ECUACION QUIMICA
Es una forma resumida de expresar, mediante símbolos y fórmulas, una reacción química. En ella determinamos las sustancias reaccionantes, se predicen los productos y se indican las proporciones de las sustancias que participan en la reacción.
Para poder representar lo que ocurre en una reacción química mediante una ecuación, ésta debe cumplir con la Ley de la conservación de la materia y con la Ley de conservación de la energía. Es decir, la ecuación debe indicar que el número de átomos de los reactivos y productos es igual en ambos lados de la flecha y que las cargas también lo son. Dicho en otras palabras, se debe contar con una ecuación balanceada.

COMO SE ESCRIBE UNA ECUACION QUIMICA
En una ecuación química, es obligatorio escribir correctamente las fórmulas y símbolos de las sustancias participantes, así como las cantidades de sus moléculas, para representar lo que ocurre durante la reacción química y al mismo tiempo constatar que todas las ecuaciones químicas se ajustan a lo que establece la Ley de conservación de la materia.
- Los pasos :

PARTES DE UNA ECUACION QUIMICA
- El símbolo "+" : entre las sustancias reaccionantes se lee como "reacciona con", entre las sustancias productos se lee como "y".
- La flecha o el signo igual a: separa a las sustancias reaccionantes de las sustancias productos. Se lee "produce".
- Un triángulo sobre la flecha o el signo igual a: significa "calor". Los reactivos deben calentarse para que la reacción se efectúe.
- Estado de agregación de las sustancias que participan, indicando una letra minúscula entre paréntesis, después de cada sustancia:(s):sólido (l): líquido (g): gas, para la sustancia en disolución se usa el símbolo (ac) que significa acuoso.
- Coeficientes: Son los números colocados antes de cada sustancia. Indican el número de moles que reaccionan de cada reactivo y el número de moles que se forman de cada producto.
METODOS PARA BALANCEAR LAS ECUACIONES
Existen diferentes métodos que se utilizan según convengan, de acuerdo al tipo de reacción, las cuales pueden ocurrir:
- Sin cambio de estados de oxidación en ningún elemento reaccionante:
- Ensayo y Error o Tanteo.
- Mínimo Común Múltiplo.
- Coeficientes Indeterminados o Algebraico.
- Algunos elementos cambian su valencia:
- Redox.
- Ion Electrón o Semirreacción: En medio ácido y básico.
CONCLUSIONES
1. una reaccion quimica tiene reactivos y productos.
2. las formulas y signos en una ecuacion son fundamentales.
3. En una reaccion se mezclan dos o mas sustancias
4. Una ecuacion se puede balancear
WEBGRAFIA
3. https://www.lifeder.com/partes-de-ecuacion-quimica/
4. http://javiercucaitamoreno.blogspot.com.co/2017/06/partes-de-una-reaccion-quimica.html
5. https://brainly.lat/tarea/1576551
6.http://www.ejemplos.co/20-ejemplos-de-reacciones-quimicas/
7.http://www.quimicas.net/2015/05/ejemplos-de-reacciones-quimicas_25.html
8. http://www.quimicaweb.net/grupo_trabajo_fyq3/tema6/index6.htm
9. https://quimica.laguia2000.com/reacciones-quimicas/clasificacion-de-las-reacciones-quimicas
10https://sites.google.com/site/smartquim/unidad-iii/clasificacion-de-reacciones-quimicas
11. http://www.hiru.eus/es/quimica/ecuaciones-quimicas-concepto-ajuste-y-tipos
12.https://www.ecured.cu/Ecuaci%C3%B3n_qu%C3%ADmica
10https://sites.google.com/site/smartquim/unidad-iii/clasificacion-de-reacciones-quimicas
11. http://www.hiru.eus/es/quimica/ecuaciones-quimicas-concepto-ajuste-y-tipos
12.https://www.ecured.cu/Ecuaci%C3%B3n_qu%C3%ADmica





BUEN TRABAJO EN LOS DOS INFORMES 5.0Ñ
ResponderEliminar