OXIGENO Y HIDROGENO
OXIGENO Y HIDROGENO
INTRODUCCION
Mediante
este blog dare a conocer todos los aspectos relacionados con el oxigeno y el
hidrogeno, como lo es su estado natural, propiedades fisicas y quimicas,
aplicaciones entre otras. De esta manera podremos desarrollar bien la
tematica y obtener buenos resultados en el momento de realizar ejercicios
relacionados con dicho tema.
Debemos
de tener en cuenta que reconocer todos los aspectos anteriormente descritos es
de fundamental importancia ya que esto lo estaremos empleando durante el tercer
periodo academico
Espero mediante este blog entender mejor todo lo
relacionado con el oxigeno y el nitrogeno como elementos basicos, poder aclarar
algunas dudas, reconocer sus usos, y beneficios diarios. Tambien aprender y
continuar avanzando en quimica.


TABLA DE CONTENIDO
2. Propiedades
fisicas
3. Propiedades
quimicas
4. Obtencion
5. Reconocimiento
6. Aplicaciones
OBJETIVO GENERAL
1. Dar
a conocer y comprender todo lo relacionado con el oxígeno
y hidrogeno en nuestro entorno como lo es su aplicación,
estado natural, sus propiedades entre otro.
OBJETIVOS ESPECIFICOS
1. Reconocer
el uso del hidrogeno y oxígeno en la fabricación de productos y su aplicación
2. Poder
conocer los procesos como y cuando se pueden obtener estos elementos del medio
ambiente o según su condición
3.
Estudiar claramente su estado natural para comprenderlo y conocer sus
capacidades

PROCEDIMIENTO
1. Entrar al ordenador y buscar la definicion de
oxigeno y nitrogeno
2. Leer el concepto y complementar con otras
fuentes de informacion
3. Escribir la informacion en el blog
4. Continuar con la consulta sobre oxigeno y
hidrogeno
5. Escribir el estado natural y propiedades
6. Consultar sobre su obtencion, reconocimiento y
aplicaciones, complementar la informacion y continuar desarrollando el blog

MARCO TEORICO
DEFINICION OXIGENO
El oxígeno es un gas incoloro e inodoro
tambien se conoce como un elemento químico que se puede encontrar en la
tabla periódica con número atómico 8 que constituye cerca de la quinta
parte del aire atmosférico terrestre en su forma molecular O2. En esta forma molecular que está compuesta por dos
átomos de este elemento siendo el tercer elemento más abundante en el
universo y representa más del 20% de la atmósfera de la tierra.
Posee nueve isótopos, el natural es una mezcla de tres de ellos. El del oxígeno-18, que se produce de forma natural, es estable y se comercializa libremente en el mercado, en forma de agua.
Posee nueve isótopos, el natural es una mezcla de tres de ellos. El del oxígeno-18, que se produce de forma natural, es estable y se comercializa libremente en el mercado, en forma de agua.
En el cuerpo humano, el oxígeno es el
elemento más abundante, representando el 65% de su masa. Respiramos
oxígeno casi cada segundo de cada día, siendo claramente muy
importante puede encontrarse en forma líquida en los laboratorios y en
forma sólida a partir de temperaturas menores a los -219º. Este elemento
es clave en la quimica organica al formar parte del agua H2O de los oxidos, de
los seres vivos y casi todos los acidos y sustancias organicas.
El
oxígeno no se reconoció hasta finales del Siglo XVIII. Quién primero lo preparó
fue Scheele, un químico sueco, en 1772. Lo identificó como uno de los
principales constituyentes del aire, y lo llamó ‘aire de fuego’ y ‘aire de
vitriolo’. No obstante, a quien se considera generalmente como su descubridor
es a Priestley, puesto que publicó sus resultados en 1774, mientras que Scheele
retrasó su publicación hasta 1777.
CARACTERISTICAS
GENERALES
- Elemento químico gaseoso
- Símbolo: O
- Ubicación: perteneciente al grupo VI de la tabla
periódica
- Número atómico: 8
- Configuración electrónica: 1s2 2s2 2p4
- Masa atómica: 15,99
- Densidad: 1,42 g/cm3
- Punto de fusión: -218,4 ° C
- Punto de ebullición: -183,0 °
- Número de protones/electrones: 8
- Número de neutrones: 8
- Clasificación: no metal
- Color: no tiene (incoloro)
- Año de descubrimiento: 1774
- Descubridor: Joseph Priestly
- Nombre de origen: de las palabras
griegas oxus (ácido)
y gennan(generar)
- Usos: sustenta la vida
- Obtenido de: aire líquido

ESTADO
NATURAL
El O2 es
el elemento más abundante de la Corteza terrestre, tanto en masa como en número
de átomos. Los átomos de oxígeno son más numerosos que los de todos los demás
elementos juntos.
 Constituye el 21% en volumen o el
23,15% en masa de la Atmósfera, el 85,8% en masa de los Océanos (el agua pura
contiene un 88,8% de oxígeno), el 46,7% en masa de la corteza terrestre (como
componente de la mayoría de las Rocas y Minerales). El oxígeno representa un
60% del Cuerpo humano. Se encuentra en todos los tejidos vivos. Casi todas las
Plantas y Animales, incluyendo los seres humanos, requieren oxígeno, ya sea en
estado libre o combinado, para mantenerse con vida.
Constituye el 21% en volumen o el
23,15% en masa de la Atmósfera, el 85,8% en masa de los Océanos (el agua pura
contiene un 88,8% de oxígeno), el 46,7% en masa de la corteza terrestre (como
componente de la mayoría de las Rocas y Minerales). El oxígeno representa un
60% del Cuerpo humano. Se encuentra en todos los tejidos vivos. Casi todas las
Plantas y Animales, incluyendo los seres humanos, requieren oxígeno, ya sea en
estado libre o combinado, para mantenerse con vida.
Los más
abundantes de los minerales que contienen oxígeno son los que incluyen además
silicio; el más sencillo de los cuales es la sílice, SiO2, principal
constituyente de la arena. Entre los que carecen de silicio, el que más abunda
es el CaCO3. En la materia viva el oxígeno está combinado con los elementos
Carbono, Azufre, Nitrógenoo Hidrógeno.

PROPIEDADES FISICAS
El oxígeno es más soluble en agua que el
nitrógeno; esta contiene aproximadamente una molécula de O2 por
cada dos moléculas de N2, comparado con la proporción en la
atmósfera, que viene a ser de 1:4. Si se suministra energía al oxígeno diatómico se obtiene la otra forma alotrópica del oxigeno conocida como ozono
La solubilidad del oxígeno en el agua
depende de la temperatura, disolviéndose alrededor del doble (14,6 mg•L−1)
a 0 °C que a 20 °C (7,6 mg•L−1).1228
A 25 °C y 1 atmósfera de presión, el agua dulce contiene alrededor de
6,04 mililitros (ml) de oxígeno por litro, mientras que el agua
marina contiene alrededor de 4,95 ml por litro A 5 °C la
solubilidad se incrementa hasta 9,0 ml (un 50 % más que a 25 °C)
por litro en el agua y 7,2 ml (45 % más) en el agua de mar.


El
oxígeno se condensa a 90,20 k (−182,95 °C, −297,31 °F) y se
congela a 54,36 K (−218,79 °C, −361,82 °F). Tanto el O2 líquido como el sólido son sustancias
con un suave color azul cielo causado
por la absorción en el rojo, en
contraste con el color azul del cielo, que se debe a la dispersión de Rayleigh de la luz azul.
El O2 líquido de gran pureza se suele obtener a través de la destilación fraccionada de aire licuado. El oxígeno líquido también puede producirse por condensación del aire, usando nitrógeno líquido como refrigerante. Es una sustancia altamente reactiva y debe separarse de materiales inflamables.
El O2 líquido de gran pureza se suele obtener a través de la destilación fraccionada de aire licuado. El oxígeno líquido también puede producirse por condensación del aire, usando nitrógeno líquido como refrigerante. Es una sustancia altamente reactiva y debe separarse de materiales inflamables.
PROPIEDADES QUIMICAS
El Oxígeno es un elemento químico gaseoso, símbolo O,
número atómico 8 y peso atómico 15.9994. Es de gran interés por ser el elemento
esencial en los procesos de respiración de la mayor parte de las células vivas
y en los procesos de combustión. Es el elemento más abundante en la corteza
terrestre.
Podemos concluir que las siguientes son las Características
físicas y químicas del oxigeno
- Densidad: 1,42 g/cm3
- Punto de ebullición: -183,0 °
- Número de protones/electrones: 8
- El oxígeno líquido tiene un color ligeramente azulado.
- El oxígeno se presenta en tres formas alotrópicas: oxígeno normal, oxígeno diatómico, oxígeno atómico y oxígeno triatómico (ozono).
- Este elemento tiene tendencia a formar moléculas diatómicas (O2).
- La propiedad química más importante del oxígeno es que soporta la combustión, es decir, ayuda a otros materiales a quemarse.
- Configuración electrónica: 1s2 2s2 2p4
- Masa atómica: 15,99
- Es poco soluble en agua, pero más soluble en agua que en nitrógeno.
- Es un elemento reactivo.
- Se caracteriza por ser un fuerte agente oxidante.
- Tiene la facilidad de combinarse con otros elementos, especialmente para formar óxidos.
- Posee elevada electronegatividad.
- Importante en el proceso de fotosíntesis, en la respiración
celular.

COMO SE OBTIENE EL
OXIGENO
Dado que constituye aproximadamente el 21% de la
atmósfera, se obtieneindustrialmente mediante destilación fraccionada del
aire líquido. En la parte alta de la columna de destilación se separa
el nitrógeno gaseoso que es el componente más volátil, mientras que
el oxígeno se recoge líquido por la base de la misma.
Para uso medicinal el oxígeno se
produce por el método de destilación fraccionada, que consiste básicamente
en el enfriamiento del aire previamente filtrado y purificado. Por métodos de
compresión-descompresión se logra el enfriado del aire hasta una
temperatura aproximada a los -183 [°C].
Otra forma de obtención del oxígeno es la electrólisis del agua a la que
previamente se le añade ácido sulfúrico o sosa con el objeto de hacerla
conductora. En este proceso se desprende hidrogeno en el cátodo y oxígeno
en el ánodo.
En el laboratorio, el oxígeno se obtiene por descomposición de algunos
de sus compuestos. Los óxidos de plata y de mercurio se descomponen
térmicamente para dar oxígeno y el metal correspondiente. El clorato de potasio
(KClO3 ) se descompone en cloruro de potasio y oxígeno en una reacción
catalizada por el dióxido de manganeso. El peróxido de sodio (Na2O2) se
descompone por la acción del agua generando hidróxido de sodio y oxígeno.


USOS Y APLICACIONES
El oxígeno es un elemento esencial para
la vida. Nuestro cuerpo y mentenecesitan oxigenarse y para ello debemos
respirar aire fresco. ... Cuando estamos al exterior, en un bosque, el campo,
junto al mar o un río, el aire que respiramos nos ayudará a oxigenar nuestro
cerebro y cada una de nuestras células.
El Oxigeno en la Respiración Humana, es
de vital importancia para los seres vivos y nuestro principal
purificador. Es necesario para la respiración, proceso mediante
el cual muchos seres vivos obtenemos energía. Forma La
Capa de Ozonode la atmósfera y está protege a los seres
vivos delas dañinas radiaciones ultravioletas del sol.
Se utiliza en la
producción de acero, plásticos y textiles; los propulsores de cohetes; la
oxigenoterapia; y la asistencia para la respiración en aeronaves, submarinos,
vuelos espaciales y submarinismo.
Como Soldaduras:
Los
procesos de soldadura se clasifican según las fuentes de presión y
calorutilizadas. El tipo de soldadura más adecuado para unir dos piezas de
metal depende de las propiedades físicas de los metales, del uso que se le dé a
la pieza y hasta de las instalaciones disponibles.
El aire
enriquecido con oxígeno se utiliza para fabricar acero en los hornos de hogar abierto.
 En la medicina
En la medicina Suministrándolo como suplemento a pacientes con dificultades respiratorias,El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, facilitando el trabajo de bombeo del corazón.La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno y se emplean botellas de oxígeno en diversas prácticas deportivas como el submarinismo o laborales, en el caso de acceder a lugares cerrados, o escasamente ventilados, con atmósferas contaminadas.
Metalurgia:
 La producción del acero depende del oxígeno. Se usa en un horno alto para convertir el carbono en dióxido de carbono, lo que reduce el óxido de hierro en hierro puro. El oxígeno también es usado en los sopletes de corte y soldadura. El oxígeno reacciona con el hidrógeno o el acetileno en los sopletes, los que se pueden calentar a más de 5.000 grados F (2760 grados centígrados). Estos sopletes pueden cortar o soldar la mayoría de metales.
La producción del acero depende del oxígeno. Se usa en un horno alto para convertir el carbono en dióxido de carbono, lo que reduce el óxido de hierro en hierro puro. El oxígeno también es usado en los sopletes de corte y soldadura. El oxígeno reacciona con el hidrógeno o el acetileno en los sopletes, los que se pueden calentar a más de 5.000 grados F (2760 grados centígrados). Estos sopletes pueden cortar o soldar la mayoría de metales.Ciencia:
 Los paleoclimatólogos miden la relación entre el oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos marinos para determinar cómo era el clima hace millones de años. Las moléculas de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12 % más pesado); esta disparidad se incrementa a bajas temperaturas. En periodos con una temperatura global más baja, la nieve y la lluvia procedentes de esa agua evaporada tienden a ser más ricas en oxígeno-16, mientras que el agua marina que queda tiende a serlo en oxígeno-18.
Los paleoclimatólogos miden la relación entre el oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos marinos para determinar cómo era el clima hace millones de años. Las moléculas de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12 % más pesado); esta disparidad se incrementa a bajas temperaturas. En periodos con una temperatura global más baja, la nieve y la lluvia procedentes de esa agua evaporada tienden a ser más ricas en oxígeno-16, mientras que el agua marina que queda tiende a serlo en oxígeno-18.
EL OXIGENO EN LA COMBUSTION
COMBUSTION
La Combustión es un proceso
químico de oxidación rápida que va acompañado de desprendimiento
de energía bajo en forma de calor y luz. Para que éste
proceso se dé, es necesario la presencia de un combustible, un comburente y
calor.El material que es capaz de arder y se combina con el oxígeno, El
oxígeno tiene la capacidad de combinarse con diversos elementos para producir
óxidos. Por ende, oxidación es la combinación del oxígeno con otra
sustancia. Existen oxidaciones que son sumamente lentas, como por ejemplo la
del hierro. Cuando la oxidación es rápida se llama combustión .
Este tipo de proceso se desprenden
energía lumínica y calórica y se llevan a cabo rápidamente.
Tal vez el proceso quimico de mayor interes practico por su escala de utilizacion mundial,
siendo a la vez muy fiacil de realizar y muy dificil de estudiar, sea el proceso de reaccion
quimica exotormica automantenida por conduccion de calor y difusion de especies, conocido
como combustion.
Sus aplicaciones se pueden resumir en:
- calefacion de habitaculos (hogueras, estufas, calderas)
- produccion de electricidad (centrales termicas)
- propulsion (motores alternativos, turbinas de vapor, turbinas de gas)
- proceso de materiales (reduccion de oxidos, fundicion, coccion)
- eliminacion de residuos (incineraci6n de basura)
- produccion de frio (frigorificos de absorcion)
- control de incendios (barreras cortafuegos, materiales ignifugos)
- iluminacion (hasta finales del siglo XIX era el unico metodo de luz artificial)

LA LLAMA
Cuando se produce la combustión de un elemento inflamable en una atmósfera rica en oxígeno, se observa una emisión de luz, que puede llegar a ser intensa, denominada llama.Las muchas reacciones de combustión son exotérmicas despiden una gran energía que se expresa en forma de calor.
La llama se produce a causa de la emisión de energía de los átomos que tienen partículas específicas están ubicadas en los gases de combustión, estos son llevados a este suceso debido al gran calor que se produce en estas reacciones. El color de la llama dependerá del medio en que se produzca y se utilice el quemador, lo que se logra con el combustible y el comburente.
Dependiendo de la combustión la llama puede ser más intensa, oscura u opaca, donde la calentura de la misma dependerá de la composición de los elementos antes mencionados (comburente y la combustión).

TIPOS DE LLAMA
Atendiendo a cómo se incorpora el oxígeno a la llama, podemos distinguir:
Llamas de premezcla.- Cuando el combustible y comburente van mezclados previamente a la combustión, como en el caso de un mechero bunsen. En estas llamas la combustión es más completa y permiten alcanzar mayores temperaturas, presentando otras características como la tonalidad azul

Llamas de difusión.- Las llamas de difusión son las que se generan de forma natural cuando se encuentran el combustible y el aire sin mezcla previa en un mismo lugar. La difusión sería el momento en el que un gas inflamable se encuentra de forma natural con el oxígeno del aire. La zona donde se produce este fenómeno se denomina zona de reacción, no es muy extensa y es donde se produce la combustión.

ESTRUCTURA DE LA LLAMA
En las llamas no luminosas se presentan tres zonas claramente definidas como se observa en la figura:
- Zona interna o interior fría, corresponde a los gases que no entran en combustión, por lo que su temperatura es baja
- Zona intermedia o de reducción, es una mezcla intermedia en la cual la combustión es incompleta y en la que se reducen los óxidos metálicos. La zona de reducción está generalmente limitada a una mera envoltura del cono interior.
- Zona exterior o de oxidación, que es la parte más externa de la llama y envuelve a las dos anteriores; por la abundancia de oxigeno hay combustión completa y la temperatura es más alta. El punto más caliente de la llama se
FORMA,COLOR Y TEMPERATURA DE LA LLAMA
La forma que presenta una llama depende del medio técnico que prepara el combustible/comburente; es decir, depende del quemador utilizado, ya que éste es el encargado de pulverizar y repartir el combustible. Si la combustión es buena, la llama no será opaca, negruzca,... El color negro lo van a dar los inquemados. La temperatura que va a alcanzar la llama dependerá de:
1. Composición y porcentaje del comburente.
2. Velocidad global de la combustión. Ésta depende de:
- Reactividad del combustible.
- Forma y eficacia del sistema de combustión.
- Temperatura inicial de los reactivos.
En los quemadores de combustibles fluidos actuales se regula las proporciones de combustibles y aire para obtener llamas de alto poder calorífico, como consecuencia de combustiones completas, contarías a las llamas luminosas que se producen en algunos quemadores por la influencia de oxígeno.
El hidrógeno es el elemento químico de número atómico 1. Se trata del
más ligero de los elementos con una masa atómica de 1,00794 (7) u y del más
abundante del universo y de la corteza terrestre (constituye el 83,9% de la
materia visible). En la atmósfera, el hidrógeno se halla como gas incoloro,
inodoro e inflamable, en su forma molecular H2.
El protio y el deuterio son los isotopos naturales del hidrógeno. El más
común en la naturaleza es el protio, que dispone de un único protón y no tiene
ningún neutrón. El tritio, por otra parte, es un isotopo artificial de
hidrógeno.
El hidrógeno es un gas incoloro, inodoro e
insípido, en estado libre sólo se encuentra en muy pequeñas cantidades en la
atmósfera, aunque se estima que el 90% del universo visible esta compuesto de
hidrógeno. En combinación con otros elementos se encuentra ampliamente
distribuido en la Tierra, en donde el compuesto más abundante e importante del
hidrógeno es el agua, H2O. El hidrógeno se halla en todos los componentes de la
materia viva y de muchos minerales. También es parte esencial de todos los
hidrocarburos y de una gran variedad de otras sustancias orgánicas. Todos los
ácidos contienen hidrógeno; una de las características que define a los ácidos
es su disociación en una disolución, produciendo iones hidrógeno.


CARACTERISTICAS
GENERALES
- El hidrógeno es el elemento más abundante, constituyendo casi tres cuartas partes de la masa del universo. Se encuentra en el agua, que cubre el 70% de la superficie terrestre, y en toda la materia orgánica
- El hidrógeno es el elemento más simple del universo: se compone de un protón y un electrón.
- El hidrógeno es el más ligero de todos los elementos y gases, y es 14 veces más ligero que el aire.
- No produce lluvia ácida, ni reduce el ozono ni produce emisiones nocivas.
- fue nombrado a partir del griego Hydro (agua) y Gen (generador)
- Se trata de un elemento químico incoloro, inodoro, de tipo gaseoso y no metálico
ESTADO
NATURAL
El hidrógeno es un gas incoloro, inodoro e insípido, en estado libre sólo se encuentra en
muy pequeñas cantidades en la atmósfera, aunque se estima que el 90% del
universo visible esta compuesto de hidrógeno.
... Para completar su nivel de valencia captura un electrón a fin de producir
el anión Hˉ
El hidrógeno es el elemento más abundante del Universo. En efecto, la mayoría de las estrellas son predominantemente de hidrógeno (el Sol tiene aproximadamente un 90% de hidrógeno). En cuanto a la Tierra, su abundancia es menor. En estado libre, se encuentra en pequeñas cantidades en la atmósfera, así como en los gases que se desprenden de los volcanes y de los yacimientos de petróleo. En combinación, por el contrario, el hidrógeno es bastante común: en el agua constituye en 11,2% de su peso total; el cuerpo humano, que es aproximadamente dos terceras partes de agua, tiene un 10% de hidrogeno por peso; forma parte esencial de todos los organismos animales y vegetales, en los cuales entra en combinación con oxígeno, nitrógeno, carbono, etc. Finalmente, es un constituyente importante del petróleo y de los gases de combustibles naturales.

El hidrógeno es el elemento más abundante del Universo. En efecto, la mayoría de las estrellas son predominantemente de hidrógeno (el Sol tiene aproximadamente un 90% de hidrógeno). En cuanto a la Tierra, su abundancia es menor. En estado libre, se encuentra en pequeñas cantidades en la atmósfera, así como en los gases que se desprenden de los volcanes y de los yacimientos de petróleo. En combinación, por el contrario, el hidrógeno es bastante común: en el agua constituye en 11,2% de su peso total; el cuerpo humano, que es aproximadamente dos terceras partes de agua, tiene un 10% de hidrogeno por peso; forma parte esencial de todos los organismos animales y vegetales, en los cuales entra en combinación con oxígeno, nitrógeno, carbono, etc. Finalmente, es un constituyente importante del petróleo y de los gases de combustibles naturales.

PROPIEDADES QUIMICAS

- Configuración electrónica: 1s1
- Número de protones/electrones: 1
- Número de neutrones: 0
- Clasificación: no metálico
- Primer potencial de ionización (eV) 13,65
- Masa atómica (g/mol) 1,00797
- Densidad (g/ml) 0,071
- Punto de ebullición (ºC) -252,7
- Punto de fusión (ºC) -259,2
- Descubridor: henry cavish
- Su estado de oxidación son +1, -1.
- Para completar su nivel de valencia captura un electrón a fin de producir el anión Hˉ.
- Las combinaciones con metales alcalinos y alcalinotérreos excepto Be y Mg., son esencialmente enlaces iónicos.
- Con los no metales son enlaces del tipo covalente.
- El H+, salvo en el estado gaseoso, en la química siempre se encuentra asociado por ejemplo: H3O (catión oxonio).
- Número atómico: 1
- Símbolo: H
- Electronegatividad 2,1
- Radio covalente (Å) 0,37
PROPIEDADES FISICAS
El hidrógeno es fácilmente absorbido por ciertos metales finamente divididos, siendo los principales paladio, platino y oro. Por ejemplo, uno volumen de paladio finamente dividido puede adsorber aproximadamente 850 volumen es de Hidrógeno a temperatura ambiente. El hidrógeno absorbido es muy activo químicamente.
- Tiene la capacidad de formar uniones iónicas.
- Presenta la capacidad de disociación cuando está en su forma molecular.
- Es casi insoluble en agua.
- En condiciones normales, es poco reactivo; pero bajo condiciones favorables, reacciona con la mayoría de los elementos.
- Es un fuerte agente reductor.
- La combinación del hidrógeno con el oxígeno forma el agua (H2O).

COMO SE
OBTIENE EL HIDROGENO
La producción de hidrógeno se realiza mediante
diversos métodos que requieren la separación del hidrógeno de otros elementos químicos, como el carbono (en
los combustibles fósiles) y el oxígeno (en
el caso del agua).
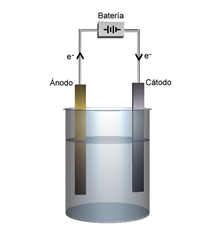
Electrólisis:
La electrólisis es un proceso que consiste en la descomposición del agua a través de la utilización de la electricidad. Este proceso industrial tiene sus ventajas, pues es fácilmente adaptable ya sea para grandes o pequeñas cantidades de gas, consiguiéndose un hidrógeno de gran pureza. La electrolisis también posee la ventaja de poder combinarse y relacionarse de manera óptima con las energías renovables con el fin de producir H2.
Reformado:
El reformado, consiste en la reacción de los hidrocarburos con la presencia de calor y vapor de agua. Dicho método permite producir grandes cantidades de hidrógeno con un bajo coste, partiendo del gas natural. Como desventaja de éste método, podemos decir, que a pequeña escala no es muy rentable ni comercial, y el hidrógeno producido suele contener impurezas, siendo incluso en ciertas ocasiones necesaria la limpieza posterior, o la realización de reacciones secundarias, con el fin de intentar purificar el producto de hidrógeno. Se suele relacionar fácilmente con la fijación del CO2, o almacenamientos de carbono, lo que hace que las emisiones del CO, incluido su proceso de fijación, supongan un problema para este método, pues genera una serie de costes adicionales

Gasificación:
El hidrógeno a través del proceso de gasificación, se obtiene a partir de hidrocarburos pesados y la biomasa, obteniéndose además del hidrógeno, gases para reformado, a partir de las reacciones del vapor de agua y el oxígeno.Este método es muy adecuado cuando se trata de hidrocarburos a gran escala, pudiendo ser usados el carbón, los combustibles sólidos, y líquidos.El hidrógeno obtenido por gasificación, presenta semejanzas con otros derivados sintéticos de la biomasa, produciendo competencia entre ellos. La gasificación de la biomasa es aún hoy en día objeto de estudio, y posee implicaciones y limitaciones pues necesita grandes extensiones de terreno.
Ciclos termoquímicos:
Este proceso utiliza el calor de bajo coste producido de la alta temperatura que procede de la energía nuclear o también de la energía solar concentrada.Es un proceso bastante utilizable y atractivo cuando se habla de gran escala, al tener bajo coste económico, y no emitiendo gases de carácter invernadero, pudiendo ser usado en la industria pesada o incluso en el transporte. Existen distintos proyectos de colaboraciones internacionales para investigar y desarrollar este método. Hoy en día, aún falta mayor investigación sin fines comerciales.

Producción biológica:
Las bacterias, y las algas, producen hidrógeno de manera natural y directa, cuando se encuentran en determinadas condiciones. Este proceso, durante los últimos años, ha sido muy estudiado, debido a su gran potencial, pero hay que decir que es un proceso bastante lento de obtención del hidrógeno, y además se necesitan grandes superficies, sin mencionar que la gran mayoría de los organismos apropiados para éste método, no se han encontrado todavía, aunque es un proceso en pleno estudio y desarrollo.
USOS Y APLICACIONES
Muchas industrias utilizan diariamente el hidrógeno en su forma líquida
y en su forma gaseosa, entre ellas, la industria petrolífera, y también se
utiliza en procesos de fabricación para producir productos químicos, alimentos
y productos electrónicos.
En lo cotidiano, el hidrógeno se utiliza fundamentalmente en el campo industrial, en el refinamiento de combustibles fósiles y amoníaco, también para fertilizantes. Las formas de producir los miles de millones de centímetros cúbicos de hidrógeno que se utilizan cada año son varias: a través del vapor de carbono calentado, la descomposición de determinados hidrocarburos con calor, las reacciones de sodio o hidróxido de potasio en aluminio, el desplazamiento de ácidos a partir de ciertos metales y la electrólisis del agua.
Otros usos comerciales e industriales del hidrógeno incluyen la fabricación de combustible para cohetes, la soldadura, la producción de ácido clorhídrico y la reducción de minerales metálicos, entre otros. Finalmente, el hidrógeno líquidoes muy importante en criogenia, así como en el estudio de la superconductividad, ya que su punto de fusión es de tan sólo 20 grados por encima del cero absoluto.
Otras apliaciones son:
- Producción de amoníaco.
- Producción del metanol.
- Elaboración de combustibles para cohetes.
- Remoción del azufre de combustibles.
- Hidrogenación de aceites y grasas.
- Fue utilizado en globos aerostáticos y dirigibles, pero por ser inflamable, provocó accidentes y se lo dejó de usar.
- Se lo puede utilizar en aplicaciones criogénicas.
- Tabién en industrias de colorantes.
El hidrógeno está actualmente siendo testeado como fuente de energía “limpia” para la utilización en transportes. La reacción del hidrógeno con el oxígeno, para producir agua, realizada en células de combustibles es una de las formas más promisorias para generar energía para automóviles, evitando la liberación de gases de efecto invernadero, al contrario de lo que sucede con los motores actuales que utilizan la combustión de hidrocarburos de origen fósil.

RECONOCIMIENTO
En 1671, Robert Boyle redescubrió y describió la reacción que se producía entre limaduras de hierro y ácidos diluidos, y que generaba hidrógeno gaseoso. Sin embargo, el descubrimiento del hidrógeno en su forma pura y de la composición del agua lo realizó Henry Cavendish en el año de 1766, llego a la conclusion que el hidrogeno forma la mayor parte de la masa de las estrellas en su fase inicial. Nuestro Sol, de hecho, es una enorme bomba de fusión de hidrógeno en el espacio. El hidrógeno, según los expertos, habría sido el primer elemento en constituirse de todos y es indispensable para la formación del agua (H2O).

CONCLUSIONES
1 1.Los dos elementos se encuentran en gran cantidad en la atmosfera y la corteza de la tierra
2. Estos elementos se pueden mezclar facilmente con otros elementos
3. El oxigeno hace parte de la combustion
4. Estos elementos son usados en la medicina, en la nasa, en pretoliferas etc...
5. Son elementos no metales
webgrafia
https://conceptodefinicion.de/combustion/
http://literaturaquimicaeloxigeno.blogspot.com/2015/05/usos-y-aplicaciones.htmlhttps://definicion.de/oxigeno/https://www.lenntech.es/periodica/elementos/o.htm
https://prezi.com/rgskfpqp6cwg/caracteristica-y-estado-natural-del-oxigeno/
https://www.textoscientificos.com/quimica/oxigeno
http://www.profesorenlinea.cl/fisica/Combustion.htm
http://webserver.dmt.upm.es/~isidoro/bk3/c15/Combustion.%20Caracteristicas.pdf
http://www.itfuego.com/Inc.%20fuego%20llamas.htm
https://es.wikipedia.org/wiki/Llama_(qu%C3%ADmica)
https://www.ecured.cu/Llama_(combusti%C3%B3n)
https://www.caracteristicas.co/hidrogeno/
https://okdiario.com/curiosidades/2016/10/14/hidrogeno-caracteristicas-h2o-450494
https://quimica.laguia2000.com/general/obtencion-del-hidrogeno
http://literaturaquimicaeloxigeno.blogspot.com/2015/05/usos-y-aplicaciones.htmlhttps://definicion.de/oxigeno/https://www.lenntech.es/periodica/elementos/o.htm
https://prezi.com/rgskfpqp6cwg/caracteristica-y-estado-natural-del-oxigeno/
https://www.textoscientificos.com/quimica/oxigeno
http://www.profesorenlinea.cl/fisica/Combustion.htm
http://webserver.dmt.upm.es/~isidoro/bk3/c15/Combustion.%20Caracteristicas.pdf
http://www.itfuego.com/Inc.%20fuego%20llamas.htm
https://es.wikipedia.org/wiki/Llama_(qu%C3%ADmica)
https://www.ecured.cu/Llama_(combusti%C3%B3n)
https://www.caracteristicas.co/hidrogeno/
https://okdiario.com/curiosidades/2016/10/14/hidrogeno-caracteristicas-h2o-450494
https://quimica.laguia2000.com/general/obtencion-del-hidrogeno






Comentarios
Publicar un comentario